Trang chủ
Tin tức mới nhất
cơ sở vật chất hiện đại
ĐỘI NGŨ CHUYÊN GIA
Bệnh viện Bạch Mai quy tụ đội ngũ chuyên gia, bác sĩ, dược sĩ và điều dưỡng được đào tạo bài bản đến chuyên sâu tại Việt nam và nhiều nước có nền y học phát triển như Mỹ, Anh, Pháp...
-
Giới thiệu
PGS. TS. Đào Hùng Hạnh
Trưởng Khoa Khám bệnh theo yêu cầu
Quá trình đào tạo - công tác
- 1991: Tốt nghiệp Bác sỹ đa khoa - ĐH Y Hà Nội
- 1995: Thạc sĩ chuyên ngành nội Cơ xương khớp - Đại học Y Hà Nội
- 1996: Thạc sĩ chuyên ngành Khoa học cuộc sống - Đại học Tổng hợp Paris 6, Pháp
- 2003: Tiến sĩ chuyên ngành y khoa - Đại học Tổng hợp Paris 6, Pháp.
- 2016: Được phong danh hiệu Phó giáo sư
Thế mạnh, kinh nghiệm công tác
- Khám và điều trị các bệnh lý Cơ - Xương - Khớp +
- Chủ nhiệm nhiều đề tài nghiên cứu về Cơ - Xương - Khớp….
-
Giới thiệu
PGS. TS. Lê Công Định
Trưởng khoa - Khoa Tai Mũi Họng
Quá trình đào tạo - công tác
Đang cập nhật
Thế mạnh, kinh nghiệm công tác
Đang cập nhật
-
Giới thiệu
TS. BS. Ngô Gia Khánh
Trưởng Khoa Phẫu thuật Lồng ngực
Quá trình đào tạo - công tác
- 2002-2008: Bác sỹ đa khoa - ĐH Y Hà Nội
- 2008-2011: Bác sỹ nội trú chuyên ngành Ngoại khoa - Đại học Y Hà Nội
- 2016- 2023: Nghiên cứu sinh Ngoại lồng ngực - Viện nghiên cứu Y dược lâm sàng 108
- Đào tạo chuyên khoa sâu tại: Nhật Bản (2019)
Thế mạnh, kinh nghiệm công tác
- Phẫu thuật lồng ngực
- Phẫu thuật mạch máu
- Phẫu thuật tuyến giáp
- Phẫu thuật ghép tạng
-
Giới thiệu
TS. BS. Vũ Trung Lương
Phó Trưởng khoa
Quá trình đào tạo - công tác
Đang cập nhật
Thế mạnh, kinh nghiệm công tác
Đang cập nhật
-
Giới thiệu
PGS.TS. Phan Thu Phương
Giám đốc - Trung tâm Hô hấp
Quá trình đào tạo - công tác
Đang cập nhật
Thế mạnh, kinh nghiệm công tác
Đang cập nhật
-
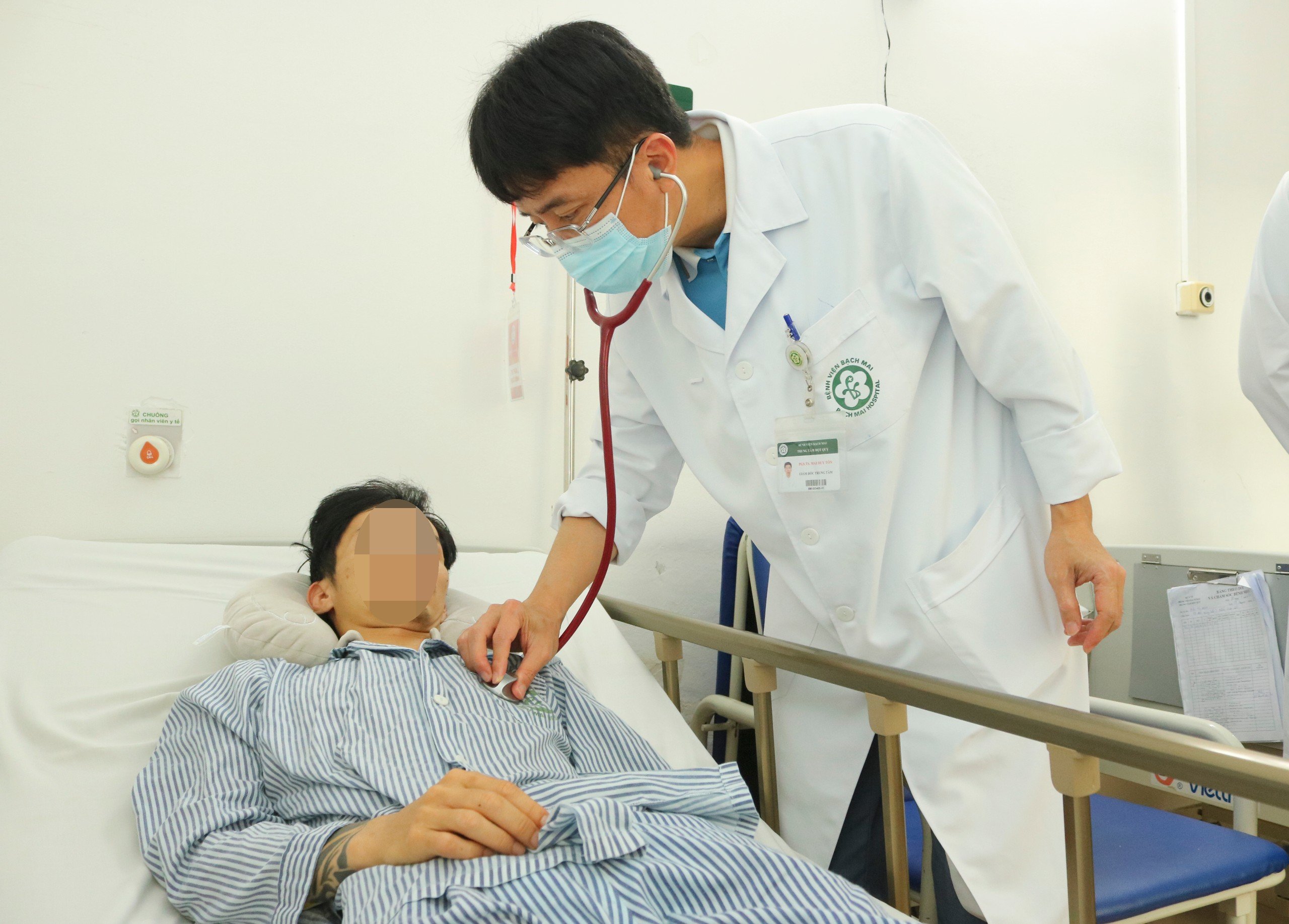
Giới thiệu
PGS. TS. Mai Duy Tôn
Giám đốc Trung tâm Đột quỵ
Quá trình đào tạo - công tác
- Từ 1994-2000; Bác sỹ đa khoa trường Đại học Y Hà nội.
- Từ 2001-2004: Bác sỹ nội trú chuyên nghành Hồi sức cấp cứu-Trường Đại học Y Hà Nội.
- Từ 2009-2012 Đào tạo Nghiên cứu sinh tại trường ĐH y Hà nội, nhận bằng Tiến sỹ năm 2013, Nhận học vị Phó giáo sư năm 2016.
- Từ 2014-2018 Đào tạo Thạc sỹ chuyên nghành Đột quỵ tại Danube University of Krems, Áo
Thế mạnh, kinh nghiệm công tác
- Đột quỵ não và Hồi sức cấp cứu
-
Giới thiệu
PGS. TS. Lương Tuấn Khanh
Giám Đốc Trung tâm Phục hồi chức năng
Quá trình đào tạo - công tác
- Năm 1994: Tốt nghiệp Đại học Y Hà nội
- Năm 1998: Tốt nghiệp Bác sĩ Nội trú Bệnh viện, chuyên ngành Phục hồi chức năng
- Năm 2002-2003: Thực tập Nội trú Bệnh viện (FFI) tại Paris - Cộng hoà Pháp (Bệnh viện Raymond-Poincare)
- Năm 2006: Thực tập tại Bệnh viện SHEBA Tel-Aviv (Irael)
- Năm 2009: Thực tập Niệu động học tại Bệnh viện Antwerpen (Bỉ)
- Năm 2010: Tiến sỹ Y khoa.
- Năm 2016: Phó Giáo sư Y học
Thế mạnh, kinh nghiệm công tác
- Thế mạnh chuyên môn: Khám, điều trị vật lý trí liệu - phục hồi chức năng, bệnh lý thần kinh – cơ, các rối loạn vận động (co cứng, loạn trương lực cơ), niệu động học, phục hồi chức năng tiết niệu – sinh dục
-
Giới thiệu
PGS. TS. Võ Hồng Khôi
Giám đốc Trung tâm Thần kinh
Quá trình đào tạo - công tác
- Tốt nghiệp Đại học chuyên ngành Bác sĩ Đa khoa năm 1999.
- Bác sĩ nội trú khóa 24 chuyên ngành Thần kinh trường Đại học Y Hà Nội năm 2000-2003.
- Tiến sĩ Y học chuyên ngành Thần kinh năm 2012.
- Được Hội đồng Giáo sư Nhà nước công nhận đạt chuẩn chức danh Phó Giáo sư năm 2023.
Thế mạnh, kinh nghiệm công tác
- Đột quỵ não và bệnh lý mạch máu não - Stroke and cerebrovascular diseases.
- Hồi sức Thần kinh - Neuro intensive care. Bệnh thần kinh tự miễn - Autoimmune neurological diseases.
- Các lĩnh vực khác thuộc chuyên ngành thần kinh - Other fields of Neurology: Đau đầu, chóng mặt (Headache, vertigo). Sa sút trí tuệ (Dementia), rối loạn giấc ngủ (Sleep disorders).
- Bệnh thần kinh ngoại biên: Viêm đa rễ và dây thần kinh, đau thần kinh toạ,… (Peripheral neuropathy: Polyradiculopathy, sciatica,...).
- Bệnh nhược cơ và các bệnh lý thần kinh cơ (Myasthenia gravis and neuromuscular diseases).
- Bệnh Parkinson và các bệnh lý rối loạn vận động khác (Parkinson disease and other movement disorders).
- Động kinh (Epilepsy),...
-
Giới thiệu
PGS. TS. Nguyễn Công Long
Giám đốc Trung tâm Tiêu Hoá - Gan Mật
Quá trình đào tạo - công tác
- Được cấp bằng ĐH năm 1999; chuyên ngành: Bác sỹ Đa khoa tại Trường Đại học Y Hà Nội
- Được cấp bằng Thạc sỹ năm 2008; chuyên ngành: Nội khoa tại Trường Đại học Y Hà Nội
- Được cấp bằng Tiến sỹ năm 2013; chuyên ngành: Nội - Tiêu hóa tại Trường Đại học Y khoa Hà Nội
Thế mạnh, kinh nghiệm công tác
- Khám chữa bệnh chuyên khoa Tiêu hóa, gan mật, Nội soi tiêu hóa, gan mật
-
Giới thiệu
PGS. TS. Đỗ Ngọc Sơn
Giám đốc Trung tâm Hồi sức tích cực
Quá trình đào tạo - công tác
- Đại học Y Hà Nội: BSĐK: 1997 BSNT: 2003
- Pickens Tech, Colorado, Mỹ: 2001
- Đại học Kanazawa, Nhật Bản: 2009
Thế mạnh, kinh nghiệm công tác
- Hồi sức hô hấp, Hồi sức tạng và hấp phụ máu, Cấp cứu trước viện, Mô hình tổ chức khoa Cấp cứu và Hồi sức tích cực
-
Giới thiệu
TS. BS. Ngô Gia Khánh
Trưởng khoa Phẫu thuật Lồng ngực
Quá trình đào tạo - công tác
- 2002-2008: Bác sỹ đa khoa - ĐH Y Hà Nội
- 2008-2011: Bác sỹ nội trú chuyên ngành Ngoại khoa - Đại học Y Hà Nội
- 2016- 2023: Nghiên cứu sinh Ngoại lồng ngực - Viện nghiên cứu Y dược lâm sàng 108
- Đào tạo chuyên khoa sâu tại: Nhật Bản (2019)
Thế mạnh, kinh nghiệm công tác
- Phẫu thuật lồng ngực
- Phẫu thuật mạch máu
- Phẫu thuật tuyến giáp
- PT ghép tạng
-
Giới thiệu
BSCKII. Phùng Thị Thuý Hằng
Phó Trưởng khoa Mắt
Quá trình đào tạo - công tác
- Đại học: Trường đại học Y Hà Nội : 1997 – 2003
- Thạc sỹ nhãn khoa : Đại học Y hà Nội : 2012 – 2014
- Bác sỹ Chuyên khoa II nhãn khoa: 2023
- Cư nhân ngành ngôn ngữ anh - Đại học Hà Nội năm 2023
Thế mạnh, kinh nghiệm công tác
- Bác sĩ điều trị chuyên khoa Mắt Bệnh viện Bạch Mai: 2006 – nay
- Học nâng cao nhãn khoa tại Ấn Độ, Canada, Hong Kong
- Các lớp chuyên khoa sâu chuyên ngành nhãn khoa trong nước
- Đăng các bài báo cáo nghiên cứu khoa học, báo cáo Hội thảo.
- Tham gia giảng dạy: Cao Đẳng Y Bạch mai, TDC Bệnh viện BạchMai
- Nhiều năm đạt chiến sỹ thi đua cấp cơ sở
- Thầy thuốc trẻ tiêu biểu TP Hà nội 2018
-
Giới thiệu
TS. BS. Hoàng Ngọc Lan
Trưởng khoa Răng Hàm Mặt
Quá trình đào tạo - công tác
- Năm 1996: Tốt nghiệp Bác sĩ chuyên khoa Răng Hàm Mặt tại trường Đại học Y Hà Nội.
- Năm 2006: Tốt nghiệp Thạc sĩ chuyên ngành Răng Hàm Mặt tại trường Đại học Y Hà Nội.
- Năm 2015: Tốt nghiệp Tiến sĩ chuyên ngành Răng Hàm Mặt tại trường Đại học Y Hà Nội.
Thế mạnh, kinh nghiệm công tác
- Có khả năng thực hành lâm sàng chuyên sâu ở nhiều lĩnh vực trong ngành Răng Hàm Mặt.
- Trên 20 năm kinh nghiệm trong lĩnh vực Phẫu thuật Hàm Mặt và Phục hình răng sứ thẩm mỹ.
- Trên 15 năm kinh nghiệm trong lĩnh vực Nắn chỉnh răng, Tiểu phẫu trong miệng và Điều trị nội nha.
- Trên 10 năm kinh nghiệm trong lĩnh vực Cấy ghép nha khoa.
-
Giới thiệu
PGS. TS. Hoàng Gia Du
Trưởng khoa Chấn thương chỉnh hình và cột sống
Quá trình đào tạo - công tác
- Tốt nghiệp Bác sĩ đa khoa - Trường Đại học Y Hà Nội
- Tốt nghiệp Thạc sĩ, Bác sĩ nội trú - Trường Đại học Y Hà Nội chuyên nghành Ngoại khoa.
- Tốt nghiệp Tiến sĩ Y học Trường Đại Học Y Hà Nội năm 2012 chuyên ngành Phẫu thuật thần kinh.
- Phó trưởng Khoa Phẫu thuật cột sống Bệnh viện Hữu nghị Việt Đức từ năm 2014-2015.
- Tham gia nhiều khóa đào tạo chuyên sâu về chẩn đoán, điều trị và phẫu thuật cột sống tại các nước: Mỹ, Canada, Đức, Pháp, Bỉ, Thái Lan, Malaysia, Singapore.
Thế mạnh, kinh nghiệm công tác
LĨNH VỰC KHÁM VÀ ĐIỀU TRỊ
- Khám và tư vấn điều trị các bệnh lý cột sống, bệnh lý thần kinh và bệnh lý cơ xương khớp
- Khám và tư vấn điều trị các triệu chứng đau, phong bế giảm đau thần kinh và cơ xương khớp, các tổn thương và di chứng sau phẫu thuật.
LĨNH VỰC PHẪU THUẬT
- Chấn thương cột sống, thoát vị đĩa đệm, trượt đốt sống
- Thay đĩa đệm nhân tạo cột sống, thay thân đốt sống nhân tạo, thay khớp háng nhân tạo
- Các phẫu thuật xâm lấn tối thiểu: Phẫu thuật vi phẫu, phẫu thuật cố định cột sống ít xâm lấn, phẫu thuật cố định cột sống và hàn xương liên thân đốt cột sống ít xâm lấn, phẫu thuật nội soi thoát vị đĩa đệm.
- Các phương pháp giảm đau: đốt sóng cao tần, phong bế thần kinh, bơm xi măng đốt sống …
- Các tổn thương khối U trong và ngoài ống sống, u tủy sống, các bệnh lý thần kinh (Chiari, …)
- Chỉnh gù - chỉnh vẹo cột sống và các dị dạng bẩm sinh cột sống
- Chỉnh gù - chỉnh vẹo cột sống do thoái hóa.
- Các tổn thương thân đốt sống – đĩa đệm do ung thư, lao hoặc viêm.
- Các tổn thương cột sống tái phát.
CÔNG TRÌNH KHOA HỌC
- Chủ nhiệm 02 đề tài nhánh cấp nhà nước
- Chủ nhiệm 07 đề tài cấp cơ sở
- Công bố 10 bài báo khoa học trên các tạp chí quốc tế uy tính (Danh mục ISI, Scopus)
- Công bố 73 bài báo trên các tạp chí khoa học uy tín trong nước
THAM GIA ĐÀO TẠO
- Giảng viên thỉnh giảng các trường đại học: Trường Đại học Y Hà Nội, Trường Đại học Y Thái Bình.
- Hướng dẫn nghiên cứu khoa học cho 11 học viên sau đại học (Nghiên cứu sinh, Bác sĩ chuyên khoa 2, Cao học, Bác sĩ nội trú).
- Chủ tọa đoàn nhiều hội nghị khoa học chuyên ngành: Hội nghị phẫu thuật cột sống toàn quốc, Hội nghị Phẫu thuật thần kinh toàn quốc, Hội nghị Thấp khớp học, …
HỘI VIÊN:
- Hội Phẫu thuật cột sống Việt Nam
- Hội Chấn thương chỉnh hình Việt Nam
- Hội phẫu thuật thần kinh
-
Giới thiệu
PGS. TS. Phạm Thị Việt Dung
Trưởng khoa Phẫu thuật Tạo hình Thẩm mỹ
Quá trình đào tạo - công tác
- Tốt nghiệp bác sĩ đa khoa hệ chính quy năm 2004, bác sĩ nội trú chuyển ngành Phẫu thuật tạo hình thẩm mỹ Trường Đại học Y Hà Nội năn 2008, bảo vệ thành công luận án Tiến sỹ y học năm 2017, được Hội đồng Giáo sư nhà nước công nhận đạt tiêu chuẩn chức danh Phó giáo sư ngày 20 tháng 11 năm 2023.
- Tham gia các khóa học chuyên sâu về Phẫu thuật tạo hình Thẩm mỹ tại Pitburg, Hoa Kỳ năm 2015 và Tsukuba Nhật Bản năm 2016
Thế mạnh, kinh nghiệm công tác
Là Chuyên gia uy tín trong lĩnh vực phẫu thuật tạo hình thẩm mỹ đặc biệt là Phẫu thuật tạo hình thẩm mỹ vú, tạo hình cơ quan sinh dục nữ và vi phẫu thuật điều trị các khuyết phần mềm lớn, phẫu thuật tái tạo các cơ quan, bộ phận trên cơ thể bị tổn khuyết phức tạp do bỏng, ung thư, chấn thương.
-
Giới thiệu
TS. BS. Trịnh Tiến Lực
Phó Giám đốc Trung tâm Thần Kinh
Quá trình đào tạo - công tác
- Tốt nghiệp bác sỹ đa khoa năm 1995 tại Trường Đại học Y Hà Nội
- Bác sĩ nội trú khoá 20 chuyên ngành Thần kinh trường Đại học Y Hà Nội năm 1996- 1999
- Được cấp bằng Tiến sĩ Y học chuyên ngành Thần kinh tại trường Đại học Y Hà Nội 2021.
Thế mạnh, kinh nghiệm công tác
- Đột quỵ não và bệnh lý mạch máu não - Stroke and cerebrovascular diseases
- Bệnh nhiễm trùng thần kinh - Neuro Infection disease
- Các lĩnh vực khác thuộc chuyên ngành thần kinh - Other fields of Neurology:
- Đau đầu, chóng mặt (Headache, vertigo)
- Sa sút trí tuệ (Dementia), rối loạn giấc ngủ (Sleep disorders)
- Bệnh thần kinh ngoại biên: Viêm đa rễ và dây thần kinh, đau thần kinh toạ,… (Peripheral neuropathy: Polyradiculopathy, sciatica,...)
- Bệnh nhược cơ và các bệnh lý thần kinh cơ (Myasthenia gravis and neuromuscular diseases)
- Bệnh Parkinson và các bệnh lý rối loạn vận động khác (Parkinson disease and other movement disorders)
- Động kinh (Epilepsy),...
-
Giới thiệu
TS. Phan Văn Đức
Phó Giám đốc Trung tâm Thần Kinh
Quá trình đào tạo - công tác
- Tốt nghiệp bác sỹ đa khoa năm 2001 tại Trường Đại học Y Hà Nội
- Bác sĩ nội trú khoá 26 chuyên ngành Thần kinh trường Đại học Y Hà Nội năm 2022-2005
- Được cấp bằng Tiến sĩ Y học chuyên ngành Thần kinh tại Viện nghiên cứu Khoa học Y Dược lâm sàng 108 năm 2015
Thế mạnh, kinh nghiệm công tác
- Đột quỵ não và bệnh lý mạch máu não - Stroke and cerebrovascular diseases
- Các lĩnh vực khác thuộc chuyên ngành thần kinh - Other fields of Neurology:
- Đau đầu, chóng mặt (Headache, vertigo)
- Sa sút trí tuệ (Dementia), rối loạn giấc ngủ (Sleep disorders)
- Bệnh thần kinh ngoại biên: Viêm đa rễ và dây thần kinh, đau thần kinh toạ,… (Peripheral neuropathy: Polyradiculopathy, sciatica,...)
- Bệnh nhược cơ và các bệnh lý thần kinh cơ (Myasthenia gravis and neuromuscular diseases)
- Bệnh Parkinson và các bệnh lý rối loạn vận động khác (Parkinson disease and other movement disorders)
- Động kinh (Epilepsy),...
-
Giới thiệu
BSCKI. Trần Thị Lan Hương
BS Chuyên ngành Nhãn khoa
Quá trình đào tạo - công tác
- Từ 1987 - 1993: Học BS Đa khoa tại Đại học Y Hà Nội
- Từ 2003 - 2005: BS Chuyên khoa Mắt tại Đại học Y Hà Nội
Thế mạnh, kinh nghiệm công tác
Bạch Mai, những ký ức hào hùng
-
Bạch Mai, những ký ức hào hùng
06/08/2023
-
Hỗ trợ bệnh viện tuyến dưới nâng cao chất lượng khám chữa bệnh
06/08/2023
-
Ghép da đầu thành công cho bệnh nhân bị tai nạn lao động
06/08/2023
-
Xin chúc mừng và mời các đồng nghiệp xem video của IFCC giới thiệu về Khoa Hóa Sinh, Viện Bạch Ma
06/08/2023